今回はボイルの法則についてダイビングの影響を分かりやすく解説します。ボイルの法則についてはダイビングライセンスのオープンウォーターのコースで必須で学びます。
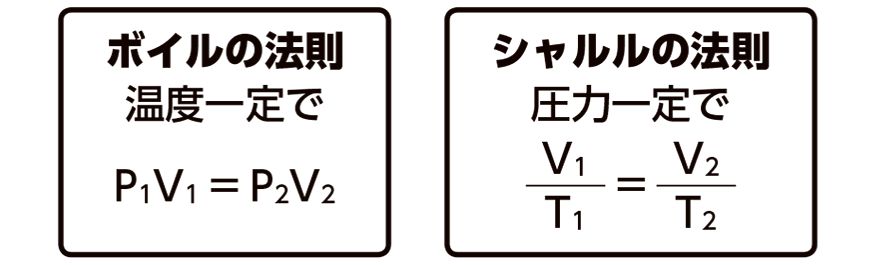
ボイルの法則は、一定の温度の下で気体の体積が圧力に反比例するという法則です。ダイビングでは、水深が深くなると圧力が増加し、それにともなって体積が減少するため、ボイルの法則が大きく関係してきます。
記事の内容は「ボイルの法則とは?」、「肺の過膨張障害(肺の破裂)とボイルの法則」、「空気の消費量とボイルの法則」、「減圧症とボイルの法則」、「シャルルの法則とは?」、「ボイルの法則 まとめ」に分けて紹介します。
ボイルの法則について復習したい方におすすめの記事の内容です。安全にダイビングを楽しむためにはボイルの法則とダイビングの影響について理解することはとても重要です。
ボイルの法則を知らないと肺の過膨張障害(肺の破裂)を起こしてしまう危険性があります。又、最悪の場合は空気の消費量の変化に気が付かないで、深い水深で空気がなくなってしまうかも知れません。
ボイルの法則とは?

ボイルの法則は、1662年にイギリスの物理学者ロバート・ボイルによって発見されました。ボイルは、さまざまな実験を通して、気体の圧力と体積の関係を詳細に調べました。
ボイルの法則は、一定の温度の下での気体の体積が圧力に反比例することを表す法則です。
ボイルの法則では体積と圧力が反比例するため、圧力が2倍になると、体積が半分になります。例えば、水面上でコップ1杯の空気は、水深10Mでは1/2に水深20Mでは1/3に水深30Mでは1/4になります。
 |
||||
 |
||||
 |
||||
 |
||||
 |
ボイルの法則は、シャルルの法則やゲイ・リュサックの法則と並んで、気体の状態を表す基本的な法則の一つです。これらの法則を組み合わせることで、さまざまな方程式を導き出すことができます。
ボイルの法則の公式
温度 T、圧力 p の平衡状態にある理想気体の体積 V は以下の二つに表される。
一定の温度の下では体積と圧力の積が一定となる。すなわち、温度が同一な二つの状態1、2について以下が成り立つ。
理想気体に対しては全ての圧力の領域で逆比例関係が成り立つが、実在気体では圧力が高い領域ではこの関係から外れる。 しかし、充分に圧力が低い領域において近似的に成り立つ。これは極限を用いて表される。
肺の過膨張障害(肺の破裂)とボイルの法則
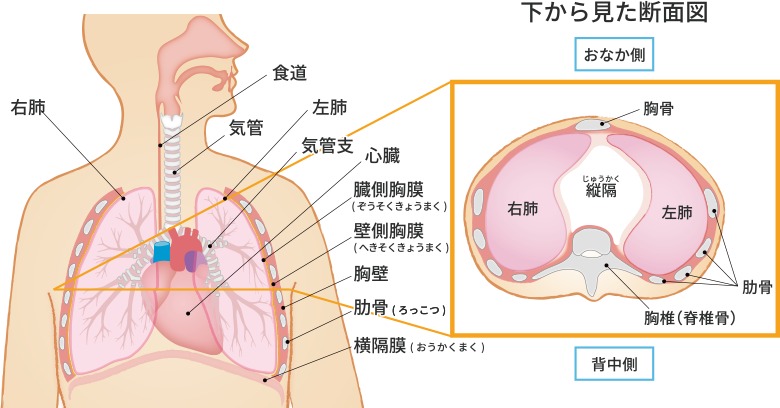
画像元 :「おしえて先生!」
ダイビング中は肺の中の空気も圧力の影響を受けることになります。ボイルの法則から考えると、浮上するときに圧力が減少すると、空気は膨張して体内空間に空気の体積が増えることになります。
耳やマスク、サイナス(副鼻腔)は空気が自然に出ていくため気にする必要はありません。
ダイビング器材は周囲と同じ圧力で空気を供給するため、肺はダイビング中も陸上にいるときと同じ体積を保つことができます。ダイバーが浮上すると肺の中の空気は膨張します。
普通に呼吸していれば息を吐くたびに膨張する空気は外に出ていくので肺は通常の体積を保ちます。
膨張する空気は重大な「肺の過膨張障害(肺の破裂)」を引き起こします。教本(マニュアル)では、ダイビング中は常に呼吸を続け、絶対に息を止めないというのがダイビングで最も重要なルールとして記載されています。
シリンダー(タンク)の空気の節約のためのスキップ呼吸なども、とても危険です。ダイビング中は一定のリズムで大きくゆっくりと深呼吸するように呼吸を続けて下さい。
例えば、水深10Mで肺いっぱいに息を吸い、息を止めて浮上すると水面での肺の空気は2倍になるため、肺が破裂してしまいます。
肺の過膨張障害(肺の破裂)は、胸部の苦しさや、口から血の混じった唾を出したり、重症の場合は意識を失い、死に至ります。
空気の消費量とボイルの法則

ダイビングでは深度とともに圧力が増加して、空気の体積は減っていきます。ダイビング器材は周囲と同じ圧力で空気を供給します。深くなればなるほど、呼吸するたびにタンクから送られてくる空気の量が増えることになります。
ボイルの法則では圧力が2倍になると、空気の体積が半分になります。例えば、陸上で100分の呼吸が可能な空気は、水深10Mでは1/2の50分に、水深20Mでは1/3の33分、水深30Mでは1/4の25分になります。
一般的なダイビングの最大水深は40Mになります。例えば陸上で100分の呼吸が可能なタンクは水深40Mまで潜ると20分に変化します。空気の消費量は水深によって大きく変わってきます。
減圧症とボイルの法則

ボイルの法則は、減圧症にも大きく関係します。減圧症は、ダイビングで体内に溶解した窒素が、浮上によって気泡となり、血管や組織を塞ぐことで起こります。
ボイルの法則は、窒素の気泡の膨張に大きく関係します。ボイルの法則では圧力が低下すると気体の体積は増加します。
浮上により体内の窒素が気泡化するタイミングで、周囲の圧力の低下によって気泡の体積が増加し、血管や組織を圧迫したり、塞栓を引き起こしたりする可能性があります。
ダイビングの深度が深くなるほど、体内に溶解する窒素の量が増加します。そのため、浮上速度が速すぎると、ボイルの法則によって気泡が急激に膨張し、減圧症のリスクが高まります。
減圧症を予防するためには、浮上スピードを遅くして、体内に溶解した窒素を安全に排出する必要があります。ダイブコンピューターやダイブテーブルを使用して安全にダイビングの計画を立てるようにしましょう。
シャルルの法則とは?

シャルルの法則は一定の圧力の下で、気体の体積と絶対温度は比例するという法則です。シャールの法則とも言います。1787年にジャック・シャルルが発見し、1802年にジョセフ・ルイ・ゲイ=リュサックによって初めて発表されました。
シャルルの法則はダイビングでは以下の内容と関係性があります。
タンク(シリンダー)の圧力変化
体積が一定のタンク内では、温度が上がると圧力が上がり、下がると圧力が低下します。 充填直後はタンクに空気を詰めると熱を持ち、圧力が高く表示されます。しかし、水中で冷やされると圧力が下がるため、実際の使用可能量に注意が必要です。(例:200barあったのが潜水開始時に180bar程度になる)
又、炎天下の車内など高温になる場所に放置すると、内部圧力が上昇しすぎて破裂や安全弁の作動を招く危険があります。
浮力調整装置(BCD)やドライスーツへの影響
温度差による体積変化によって、暖かい水域から冷たい水域(サーモクライン)へ移動すると、BCDやドライスーツ内の空気が冷やされて収縮し、体積が減少します。
シャルルの法則の公式
シャルルの法則は、ボイルの法則やゲイ・リュサックの法則と並んで、気体の状態を表す基本的な法則の一つです。これらの法則を組み合わせることで、さまざまな方程式を導き出すことができます。
一定の圧力下で、温度上昇に対して気体の体積が単調に増加し、一定の温度上昇に対して気体の種類に依らず同じく膨張します。
ボイルの法則 まとめ

今回はボイルの法則についてダイビングの影響を分かりやすく解説しました。ボイルの法則は、一定の温度の下で気体の体積が圧力に反比例するという法則です。
ボイルの法則では体積と圧力が反比例するため、圧力が2倍になると、体積が半分になります。例えば、水面上でコップ1杯の空気は、水深10Mでは1/2に水深20Mでは1/3に水深30Mでは1/4になります。
例えば、水深10Mで肺いっぱいに息を吸い、息を止めて浮上すると水面での肺の空気は2倍になるため、肺が破裂してしまいます。
肺の過膨張障害(肺の破裂)は、胸部の苦しさや、口から血の混じった唾を出したり、重症の場合は意識を失い、死に至ります。
ボイルの法則では圧力が2倍になると、空気の体積が半分になります。例えば、陸上で100分の呼吸が可能な空気は、水深10Mでは1/2の50分に、水深20Mでは1/3の33分、水深30Mでは1/4の25分になります。

ボイルの法則は、減圧症にも大きく関係します。ボイルの法則では圧力が低下すると気体の体積は増加します。
浮上により体内の窒素が気泡化するタイミングで、周囲の圧力の低下によって気泡の体積が増加し、血管や組織を圧迫したり、塞栓を引き起こしたりする可能性があります。
シャルルの法則は一定の圧力の下で、気体の体積と絶対温度は比例するという法則です。タンクの充填直後は空気を詰めると熱を持ち、圧力が高く表示されます。(例:200barあったのが潜水開始時に180bar程度になる)
安全にダイビングを楽しむためにはボイルの法則とダイビングの影響について理解することはとても重要です。
ボイルの法則を知らないと肺の過膨張障害(肺の破裂)を起こしてしまう危険性があります。又、最悪の場合は空気の消費量の変化に気が付かないで、深い水深で空気がなくなってしまうかも知れません。
#ボイルの法則 #シャルルの法則




